Startseite » Brustkrebs » Zielgerichtete Therapie
Zielgerichtete Therapie
Seit einigen Jahren ergänzen die zielgerichteten Therapien (targeted therapies) die medikamentösen Therapiemöglichkeiten beim Mammakarzinom. Zielgerichtet bedeutet, dass diese Medikamente gezielt auf Krebszellen wirken und dort Prozesse ausschalten, die für das Wachstum und Überleben von Tumorzellen besonders wichtig sind. Es kann manchmal auch am Tumorgewebe untersucht werden, ob solche Therapieziele (z.B. HER2, PD-L1, PIK3CA) für Ihre Tumorzellen wichtig sind.
aktualisiert am 03.09.2025
Inhaltsverzeichnis
Gruppen der zielgerichteten Therapie
Das Wirkprinzip ist ein „Schlüssel-Schloss-Mechanismus“. Die Medikamente (=Schlüssel) müssen zu einem „Schloss“ (= Tumoreigenschaft) passen und können dann wirken. Zielgerichtete Therapien werden in der Regel mit anderen Therapien (Chemotherapie oder Antihormontherapie) kombiniert eingesetzt und verstärken deren Wirkung, meist ohne allzu große Nebenwirkungen zu verursachen.
Zur Gruppe der gezielt wirkenden Medikamente zählen:
- anti-HER2 Therapien (Trastuzumab (Herceptin®), Pertuzumab (Perjeta®), Trastuzumab-Emtansin (Kadcyla®), Lapatinib (Tyverb®), Neratinib (Nerlynx®), Trastuzumab-Deruxtecan (Enhertu®), Tucatinib (Tukysa®))
- anti-VEGF Antikörper Bevacizumab (Avastin®)
- PD-L1 / PD-1 Inhibitoren Atezolizumab (Tecentriq®), Pembrolizumab (Keytruda®)
- CDK4/6 Inhibitoren Palbociclib (Ibrance®), Ribociclib (Kisqali®), Abemaciclib (Verzenios®)
- mTOR Inhibitoren Everolimus (Afinitor®)
- PIK3CA Inhibtioren Alpelisib (Piqray®), Inavolisib (Aleclibran®)
- PARP Inhibitoren Olaparib (Lynparza®), Talazoparib (Talzenna®)
- gegen Trop-2 gerichtetes Antibody-Drug-Conjugate Sacituzumab-Govitecan (Trodelvy®)
Was bedeutet HER2 bei Brustkrebs?
HER2 sind so genannte Rezeptoren (das können Sie sich wie „Antennen“ oder „Schalter“ vorstellen) an der Oberfläche von Zellen. Wenn viele solcher HER2-Rezeptoren auf Brustkrebszellen vorhanden sind (das nennt man dann „HER2-positiver“ Tumor), dann teilen die Zellen sich häufiger und der Tumor wächst schneller und unkontrollierter. Aber keine Angst: seitdem es Medikamente gibt, die HER2 gezielt hemmen/blockieren, haben Patientinnen mit HER2-positivem Tumor keinen ungünstigeren oder aggressiveren Krankheitsverlauf mehr. Brustkrebs wird als HER2-positiv bezeichnet, wenn bei der histopathologischen Untersuchung auf den Tumorzellen sehr hohe Mengen von HER2 nachgewiesen wurden. In Ihrem Befund aus der Pathologie steht dann „HER2+“ oder „HER2-positiv“ (Achtung: dies dürfen Sie bitte nicht mit „HR-positiv“ verwechseln! Unter HR (=Hormonrezeptor) fassen einige Pathologen die Hormonrezeptoren ER und PR zusammen. Das hat nichts mit HER2 zu tun!). Der Nachweis vermehrter HER2-Rezeptoren erfolgt immunhistochemisch (IHC) oder mittels in situ-Hybridisierung (CISH oder FISH). HER2-positiv sind die folgenden Befunde:
- IHC 3+
- IHC 2+ UND ISH+
- ISH+
Wenn bei HER2-positivem Brustkrebs neben der adjuvanten Chemotherapie eine Therapie mit einem HER2-Antikörper stattfindet, ist das Rückfallrisiko vor allem bei Tumoren im Frühstadium gering.
HER2-negativ und somit nicht geeignet für Medikamente, die sich gegen HER2 richten, sind folgende Tumore:
- IHC 0
Was bedeutet HER2-low?
Dass man nicht mehr nur zwischen HER2-positiven und HER2-negativen Tumoren unterscheidet, sondern es auch eine Gruppe „dazwischen“ gibt, die als „HER2-low“ eingeordneten Tumoren mit einer niedrigen Expression des HER2-Rezeptors, ist noch relativ neu. Dazu zählen folgende Befundkonstellationen:
- IHC 1+
- IHC 2+ und ISH-
Diese Fälle wären vor 2022 noch als „HER2-negativ“ eingeordnet worden und machen mehr als die Hälfte der nicht deutlich HER2-positiven Tumore aus. Dass Tumoren mit einer niedrigen HER2-Expression nun als eigenständige Kategorie angesehen werden, hat auch zu einer Veränderung der Behandlungsempfehlungen geführt. Patientinnen mit einem HER2-low Tumor werden jetzt anders behandelt als HER2-negative oder deutlich HER2-positive Brustkrebs-Fälle und können in der metastasierten Situation mit dem Antikörper-Wirkstoff-Konjugat Trastuzumab Deruxtecan behandelt werden. Es profitieren jetzt also deutlich mehr Patientinnen von Behandlungsmöglichkeiten gegen HER2!
Welche zielgerichteten Therapien gegen HER2 werden bei Brustkrebs eingesetzt?
Inzwischen stehen verschiedene zielgerichtete Medikamente, die HER2 hemmen und so die ungünstigen Effekte verhindern oder die HER2 als „Eintrittspforte“ in Brustkrebszellen nutzen, zur Verfügung. Diese Medikamente sind keine Chemotherapien, sondern Antikörper oder Tyrosinkinasehemmer. Alleine (ohne Chemotherapie) verabreicht (so genannte Monotherapie) verursachen diese anti-HER2-Medikamente kaum oder vergleichsweise wenige Nebenwirkungen, da gesunde Körperzellen keinen HER2–„Schalter“ besitzen und HER2-negativ sind.
Da aber insbesondere zu Beginn der Therapie eine Kombination mit einer Chemotherapie erfolgt, um die Wirkung zu steigern, kommen in dieser Zeit die Nebenwirkungen von Chemotherapie und anti-HER2 Therapie zusammen und verstärken sich manchmal. Sobald die anti-HER2 Therapie alleine als Erhaltungstherapie verabreicht wird, berichten nur wenige Patientinnen von beeinträchtigenden Nebenwirkungen.
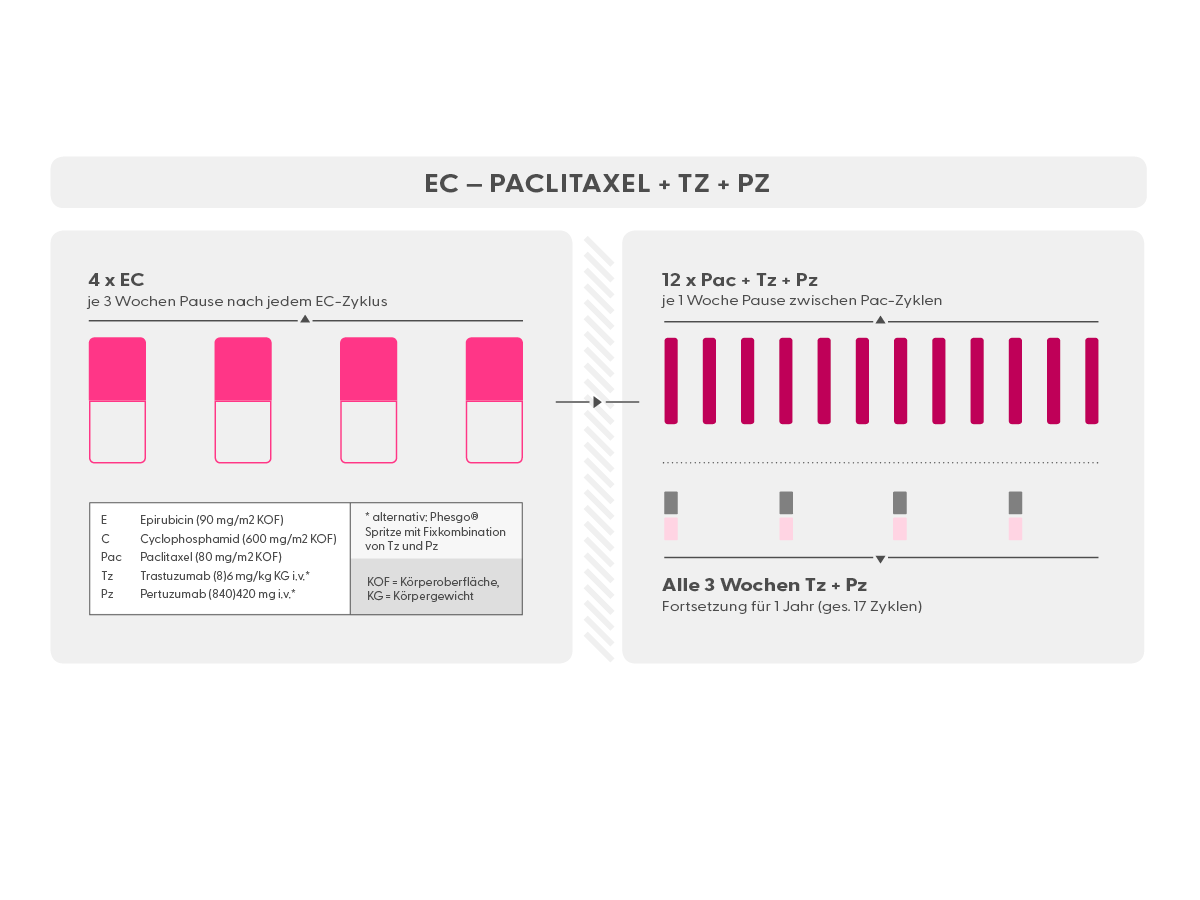
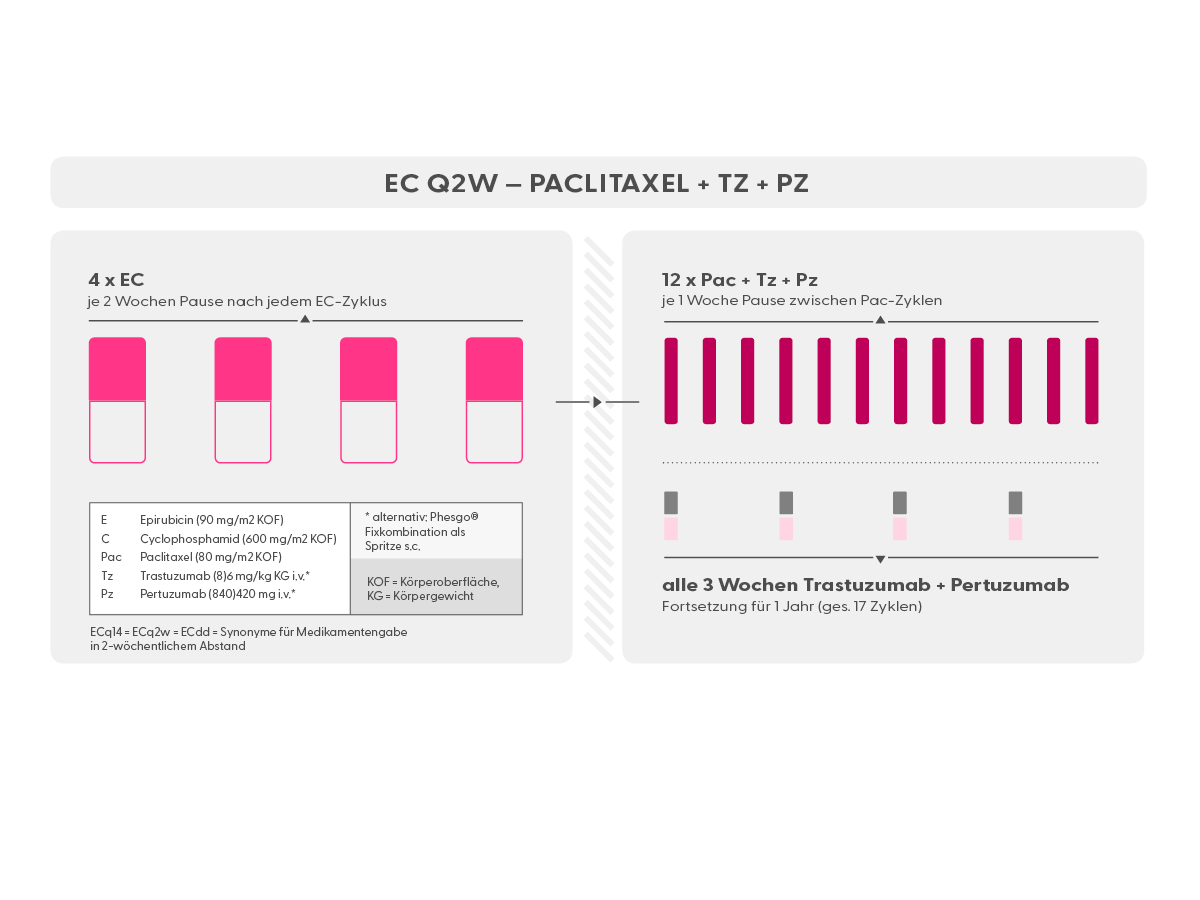
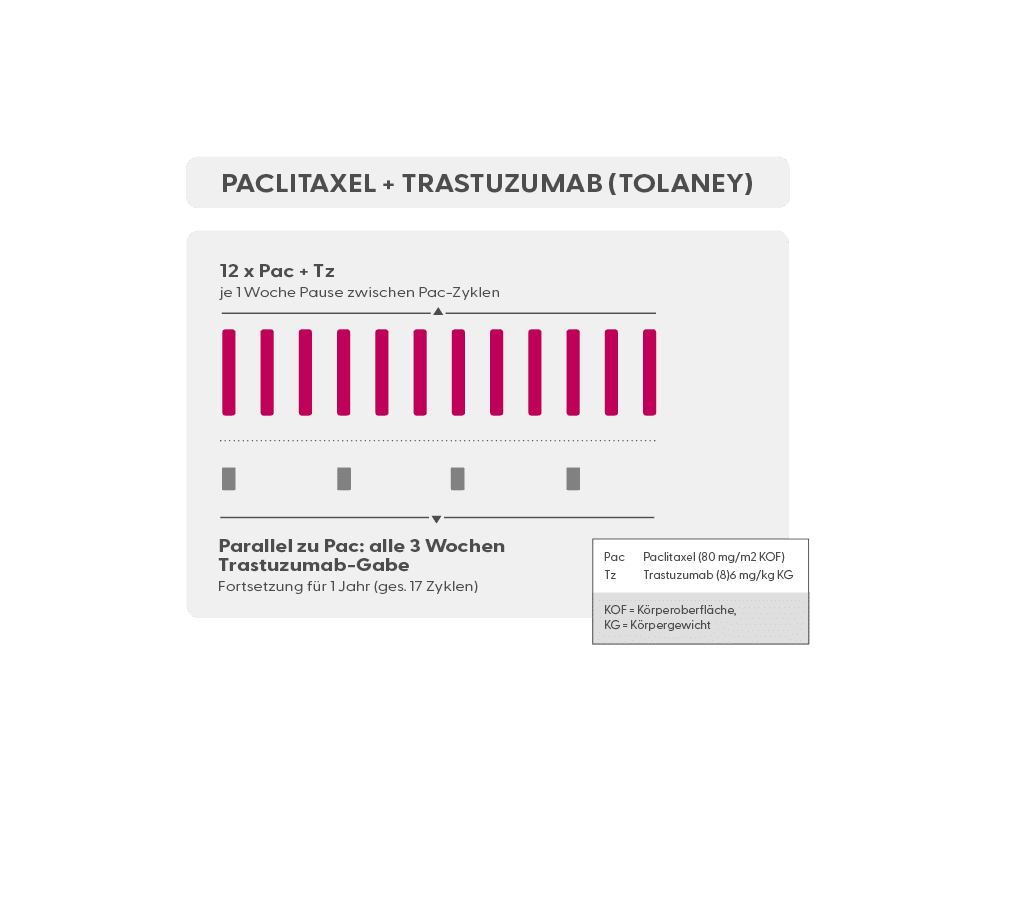
- Trastuzumab (Herceptin®) ist ein Antikörper, der gegen HER2 auf Mammakarzinomzellen gerichtet ist. Eine Therapie mit Trastuzumab (meist zunächst in Kombination mit einer Chemotherapie; oft in Kombination mit Pertuzumab) ist in allen Stadien des HER2-positiven Mammakarzinoms indiziert, also neoadjuvant, adjuvant und in der metastasierten Situation. Trastuzumab ist als Infusion (Erstgabe über 90 min., Folgegaben über 30 min.), als subkutane Spritze (s.c.) und als subkutane Spritze in Fixkombination mit Pertuzumab (Phesgo®, s.u.) verfügbar. Trastuzumab muss alle 3 Wochen verabreicht werden.
Nebenwirkungen: Trastuzumab kann insbesondere bei Patientinnen, die mit Anthrazyklinen behandelt wurden, die Herzfunktion beeinträchtigen (daher wird vor Beginn einer Therapie die Herzfunktion gründlich überprüft). Mögliche weitere aber eher seltenere Nebenwirkungen, die sich zum Teil auch aus der Kombination mit Chemotherapie oder Pertuzumab ergeben, sind Infektionen, Entzündung der Nasen- und Rachenschleimhaut, Veränderungen des Blutbildes, Abgeschlagenheit, trockene Haut und Schleimhäute, Grippe-ähnliche Symptome, Durchfall, Übelkeit.
- Pertuzumab (Perjeta®) ist wie Trastuzumab ein Antikörper gegen HER2. Er dockt allerdings an einer anderen Stelle am HER2-Rezeptor an. Pertuzumab verstärkt die Wirkung von Trastuzumab deutlich. Daher werden diese beiden Antikörper meist gemeinsam verabreicht. Die Wirkweise, die Nebenwirkungen und die Indikation sind dem Trastuzumab vergleichbar (s.o.). Pertuzumab ist als Infusion (Erstgabe über 90 min., Folgegaben über 30 min.) und als subkutane Spritze in Fixkombination mit Trastuzumab (Phesgo® , s.u.) verfügbar. Pertuzumab muss alle 3 Wochen verabreicht werden.
- Fixkombination (Spritze) aus Trastuzumab und Pertuzumab (Phesgo®): Die beiden bekannten und schon lange Jahre in der Therapie von HER2-positivem Brustkrebs eingesetzten Antikörper Pertuzumab und Trastuzumab stehen seit einiger Zeit auch als Fixkombination und in Form einer Spritze zur subkutanen (s.c.) Injektion zur Verfügung (Phesgo ®). Wie üblich, werden die Antikörper zunächst mit einer Chemotherapie kombiniert. Bislang musste Pertuzumab bei der anschließenden Erhaltungstherapie immer als Infusion über die Vene (intravenös) verabreicht werden. Dies ändert sich nun mit der subkutan zu applizierenden Darreichungsform. Für Patientinnen bedeutet dies, dass sie die doppelte Antikörperblockade mit Trastuzumab und Pertuzumab nun schneller und weniger aufwändig erhalten können, wenn sie eine Spritze unter die Haut der Infusion vorziehen. Die Erstgabe von Phesgo® sollte über acht Minuten erfolgen. Im Vergleich dazu dauert die erste Infusion (intravenöse (i.v.) Gabe) bis zu 2,5 Stunden. Die Folgegaben der Spritze sollen (wie auch bei den Infusionen) alle drei Wochen erfolgen und dürfen dann etwas schneller appliziert werden (über 5 Minuten). Die Wirksamkeit der kombinierten Spritze ist der Wirksamkeit der Infusion vergleichbar. Die Spritze ist sehr gut verträglich und verursacht wenig Nebenwirkungen.
Nebenwirkungen (wie bei Trastuzumab und Pertuzumab): Durchfall, Übelkeit, Blutarmut (Anämie), Müdigkeit, Gelenkschmerzen und Haarausfall (letzterer ist auf die gleichzeitige Gabe der Chemotherapie zurückzuführen). Da die Medikamente direkt unter die Haut gespritzt werden, kann es hier zu Reizungen und Irritationen kommen.
- Trastuzumab-Emtansin (T-DM1, Kadcyla®): T-DM1 (Kadcyla®) ist eine Kombination aus Trastuzumab (Antikörper) und einer Chemotherapie (Maytansin). Man bezeichnet diese Art eines Medikamentes als sogenanntes „Antibody-Drug-Konjugat“ (ADC) oder „Antikörper-Wirkstoff-Konjugat“. ADCs funktionieren wie ein Trojanisches Pferd: Sie schleusen das wirksame Medikament gezielt in Tumorzellen ein und setzen dieses erst dort frei. Dieses zielgerichtete Eindringen in Tumorzellen funktioniert über den Schlüssel-Schloss-Mechanismus: ein Teil des Medikaments ist ein Antikörper, der an ein besonderes Merkmal an der Brustkrebszell-Oberfläche andocken kann. So werden normale Körperzellen, die dieses Merkmal nicht haben, verschont und es treten weniger unerwünschte Nebenwirkungen durch das an den Antikörper gekoppelte und in die Zelle eingeschleuste Krebs-Medikament auf. T-DM1 bindet z.B. nur an HER2-positive Zellen. Nach Bindung an den HER2-Rezeptor wird das Medikament in die Tumorzelle geschleust. Dort wird die Chemotherapie (Maytansin) freigesetzt. So hat man zwei Effekte: den der Chemotherapie und die Wirkung von Trastuzumab gegen HER2. Der große Vorteil ist, dass T-DM1, da es ja an HER2-Rezeptoren andocken muss, in Zellen, welche keinen HER2-Rezeptor tragen (gesunde Körperzellen), nicht aufgenommen wird. Daher entstehen trotz hoher Wirksamkeit kaum Nebenwirkungen. T-DM1 wird alle drei Wochen in die Vene als Infusion (i.v.) verabreicht. Indikation: 1. T-DM1 darf in der Therapie des metastasierten HER2-positiven Brustkrebses eingesetzt werden, wenn Trastuzumab bzw. die Kombination von Trastuzumab und Pertuzumab nicht mehr wirkt (sog. Zweitlinientherapie). 2. Eine weitere Anwendungsmöglichkeit ist die Gabe beim HER2-positiven frühen Brustkrebs als post-neoadjuvante Therapie, wenn also nach neoadjuvanter Behandlung mit Chemotherapie und antiHER2-Therapie (Trastuzumab und ggf. Pertuzumab) noch ein Tumorrest übriggeblieben ist.
Nebenwirkungen: Die häufigste Nebenwirkung von T-DM1 ist die so genannte Thrombozytopenie (das heißt eine reduzierte Zahl an Blutplättchen). Weitere Nebenwirkungen, die bei nur sehr wenigen Patientinnen auftreten, sind erhöhte Leberwerte, Blutarmut und Erschöpfungszustände.
- Trastuzumab Deruxtecan (T-DXd, Enhertu®): ist ebenfalls ein Antikörper-Wirkstoff-Konjugat (ADC), also ein Trojanisches Pferd. Es kann zur Therapie einer stark vorbehandelten fortgeschrittenen oder metastasierten HER2-positiven Erkrankung eingesetzt werden, wenn bereits mindestens eine gegen HER2 gerichtete Vorbehandlung erfolgt ist. Auch beim HER2-low fortgeschrittenen oder metastasierten Brustkrebs, wenn zuvor eine Chemotherapie in der metastasierten Situation gegeben wurde oder die Krankheit sehr schnell (während oder innerhalb von 6 Monaten nach einer adjuvanten Chemotherapie) wieder aufgetreten ist, ist ein Einsatz möglich. Trastuzumab Deruxtecan wird als Monotherapie, also ohne Kombination mit weiteren Medikamenten wie z.B. einer zusätzlichen Chemotherapie, eingesetzt.
Der Antikörper ist ein anti-HER2-Antikörper, der über einen abspaltbaren Linker an Deruxtecan (DXd), einen Topoisomerase-I-Inhibitor (DXd) gebunden ist. Nach der Bindung des Medikaments an den HER2-Rezeptor an der Oberfläche der Brustkrebszelle wird es in die Zelle eingeschleust. Hier wird dann der Topoisomerase-I-Inhibitor (DXd) freigesetzt, verursacht Schäden am Erbgut der Krebszelle und führt durch Apoptose zum Tod der Tumorzelle. Wie bei T-DM1 vermittelt auch bei diesem Medikament der Antikörper Trastuzumab die ADCC (antikörperunabhängige zelluläre Zytotoxizität) in menschlichen Brustkrebszellen, die HER aufweisen. Die Verabreichung erfolgt alle drei Wochen als Infusion.
Nebenwirkungen: v.a. Übelkeit und Erschöpfung, Haarverlust (46%), Blutbildveränderungen und eine Lungenerkrankung (Pneumonitis).
- Tyrosinkinase-Hemmer/-Inhibitoren gegen HER2:
- Lapatinib (Tyverb®) wirkt ebenfalls nur an HER2-positiven Brustkrebszellen, ist aber kein Antikörper, sondern ein so genannter Tyrosinkinasehemmer („small molecule“). Lapatinib kann als Monotherapie (alleine) oder in Kombination mit Trastuzumab oder einer Chemotherapie eingesetzt werden, wenn unter Trastuzumab-Therapie die Brustkrebs-Erkrankung wieder fortschreitet. Lapatinib ist eine Tablettentherapie mit mehr Nebenwirkungen als die Antikörper gegen HER2: insbesondere Durchfall, Übelkeit, Erbrechen, Hautausschlag, Müdigkeit, Schwächung der Herzleistung.
- Neratinib (Nerlynx®) ist ebenfalls ein „small molecule“ gegen HER2 und kann bei der Behandlung des HER2-positiven und hormonrezeptorpositiven Brustkrebses im Anschluss an eine 1-jährige Trastuzumab-Therapie eingesetzt werden. Neratinib wird als Tablette verabreicht. Nebenwirkungen: häufig Durchfälle, weniger häufig Übelkeit, Erbrechen, Müdigkeit, Bauchschmerzen und Hautausschlag.
- Tucatinib (Tukysa®) ist ebenfalls eine Tablettentherapie, die sich gegen die HER2 Tyrosinkinase richtet und seit 2021 für Frauen mit einer HER2-positiven fortgeschrittenen oder metastasierten Brustkrebserkrankung zugelassen, wenn zuvor mindestens zwei andere gegen HER2 gerichtete Therapien erfolgt sind. Tucatinib hemmt die Aktivierung (oder: Phosphorylierung) von HER2 und HER3, was zu einer Hemmung der nachgelagerten Zellsignalübertragungen und dem Wachstum (=Proliferation) und infolgedessen zum Absterben von Tumorzellen führt. Tucatinib wird mit Trastuzumab und Capecitabin kombiniert. Nebenwirkungen: v.a. Durchfall, Übelkeit, Erbrechen, erhöhte Leberwerte, Ausschlag.
Mögliche Kombinationen von Chemotherapie mit anti-HER2 Therapien
- T-DM1 (Kadcyla®)) (ein Chemo-Antikörper-Konjugat); Abbildung demnächst online
- Capecitabin (Xeloda®) + Lapatinib (Tyverb®) (Capecitabin = Tabletten-Chemotherapie) ; Abbildung demnächst online
- Capecitabin (Xeloda®) + Neratinib (Nerlynx®) (Capecitabin = Tabletten-Chemotherapie); Abbildung demnächst online
- Tucatinib (Tukysa®) + Capecitabin (Xeloda®) + Trastuzumab (Herceptin®); Abbildung demnächst online
- Trastuzumab Deruxtecan (Enhertu®) (ein Antikörper-Wirkstoff-Konjugat); Abbildung demnächst online
- Docetaxel (Taxotere®) + Trastuzumab (Herceptin®) + Pertuzumab (Perjeta®); Abbildung demnächst online
- Docetaxel (Taxotere®) + Carboplatin + Trastuzumab (Herceptin®) + Pertuzumab (Perjeta®); Abbildung demnächst online
Antikörper-Wirkstoff-Konjugat beim triple-negativen metastasierten/chronischen Mammakarzinom (TNBC): Sacituzumab-Govitecan (Trodelvy®)
- Sacituzumab Govitecan (Trodelvy ®) ist seit Ende 2021 zur Behandlung beim fortgeschrittenen oder metastasierten triple-negativen Brustkrebs zugelassen, die zuvor zwei oder mehr (Chemo-)Therapien erhalten haben, darunter mindestens eine für die fortgeschrittene Erkrankung. Seit Dezember 2023 ist es auch gelassen als Monotherapie bei nicht-resezierbarem oder metastasiertem HR‑positivem, HER2‑negativem Brustkrebs nach vorheriger endokriner Therapie und mindestens zwei weitere systemische Therapien im metastasierten Setting. Sacituzumab Govitecan ist ein gegen Trop-2 gerichtetes Trojanisches Pferd (Antibody-Drug-Conjugate , ADC). Trop-2 (=Trophoblast-Oberflächen-Antigen-2) kommt häufig an der Oberfläche solider Tumoren vor. Es wird auch beim TNBC überexprimiert und korreliert mit einem schlechteren Krankheitsverlauf. Sacituzumab Govitecan bindet an Trop-2 an der Oberfläche von Brustkrebszellen und wird so in die Zelle geschleust. Dort wird der eigentliche Wirkstoff SN-38, ein stark wirksamer Topoisomerase-I-Hemmer, freigesetzt. Dieser zerstört die Brustkrebszelle, indem er die Reparatur von Zellschäden verhindert, was zum Zelltod führt. Sacituzumab Govitecan wird als Infusion verabreicht. Nebenwirkungen: v.a. Veränderung des Blutbildes (niedrige weiße Blutkörperchen, Anämie), Durchfall und Übelkeit. Vor jeder Gabe von Sacituzumab Govitecan wird eine Behandlung zur Vermeidung allergischer Reaktionen und zur Vermeidung von Übelkeit und Erbrechen empfohlen. Seit kurzem ist auch eine Prophylaxe mit G-CSF (zur Neubildung der weißen Blutkörperchen) empfohlen.
Antikörpertherapie gegen VEGF beim triple-negativen metastasierten/chronischen Mammakarzinom (TNBC): Bevacizumab (Avastin®)
- Bevacizumab (Avastin®) ist ebenfalls ein Antikörper. Er richtet sich gegen VEGF, also gegen die Gefäßwand und hemmt die Bildung von Blutgefäßen. Bevacizumab kann beim metastasierten HER2-negativen Mammakarzinom in Kombination mit einer Chemotherapie (Paclitaxel oder Capecitabin) eingesetzt werden. Diese Kombination von Bevacizumab mit einer Chemotherapie hat das Fortschreiten der Erkrankung verzögert und zu einer Verbesserung der Lebensqualität geführt. Die Wirksamkeit der Chemotherapie wird also deutlich gesteigert und das bei vergleichsweise geringen zusätzlichen Nebenwirkungen. Der Einsatz sollte möglichst früh in der metastasierten Situation erfolgen (möglichst in der Erstlinientherapie). Nach Beendigung der Chemotherapie kann Bevacizumab als Erhaltungstherapie fortgeführt werden. Eine alleinige Behandlung mit Bevacizumab kann als Erhaltungstherapie auch nach Beendigung der begleitenden Chemotherapie erfolgen. Nebenwirkungen: Bevacizumab verursacht wenig die Patientinnen belastende Nebenwirkungen. Beobachtet werden Erschöpfung und allergische Reaktionen, seltener Magen-Darm-Blutungen, Blutgerinnsel (Thrombose) und Bluthochdruck sowie eine vermehrte Eiweißausscheidung über die Niere.
- Kombinationen von Chemotherapie mit Antikörpern gegen VEGF (nur beim metastasierten Mammakarzinom) Pac 12 x wöchentlich + Bevacizumab
Immuntherapie beim triple-negativen metastasierten/chronischen Mammakarzinom (TNBC): Atezolizumab (Tecentriq®), Pembrolizumab (Keytruda®)
Was bedeutet PD-1 / PD-L1 im Zusammenhang mit der Immuntherapie bei Brustkrebs?
- PD-1 ist ein Eiweiß, das man auf aktivierten T-Zellen findet. Die T-Zellen sind weiße Blutkörperchen und somit Teil des zellulären Immunsystems. PD steht für „programmed cell death“, also programmierten Zelltod. Der Körper steuert das Immunsystem, um eine Überaktivierung der T-Zellen zu verhindern, indem er T-Zellen inaktiviert/ausschaltet, wenn PD-L1 (programmed cell death ligand 1) oder PD-L2 (programmed cell death ligand 2) an PD-1 binden. PD-L1 hemmt also das Abwehrsystem des Körpers.
- PD-L1 wird nun auch von einigen Brustkrebsarten gebildet. Die Krebszellen schützen sich damit vor einem Angriff durch die T-Zellen und „verstecken“ sich quasi vor dem Immunsystem. Der Brustkrebs kann also schlechter bekämpft werden. Die neuen Immuntherapien setzen hier an und verhindern, dass die Krebszellen sich so selbst schützen können.
Welche Immuntherapien gibt es bei Brustkrebs?
- Atezolizumab (Tecentriq®) ist in Deutschland für Frauen mit metastasiertem oder fortgeschrittenen triple-negativem Mammakarzinom (TNBC) (also ohne Nachweis einer Hormonempfindlichkeit der Tumorzellen: ER negativ, PR negativ, HER2 negativ) und Nachweis einer PD-L1 Expression auf den die Brustkrebszellen umgebenden Immunzellen (IC) zugelassen. Atezolizumab bindet an PD-L1 (PD-L1 Inhibitor), hebt also die Blockade von PD-1 auf und reaktiviert dadurch das Immunsystem des Körpers. Atezolizumab wird bei Brustkrebs mit der Chemotherapie nabPaclitaxel kombiniert. Atezolizumab wird dabei alle 4 Wochen als Infusion gegeben. In den ersten drei Wochen dieses 4-Wochen Zyklus wird zusätzlich nabPaclitaxel gegeben. Diese Behandlung wird durchgeführt, bis es zum Fortschreiten der Erkrankung kommt.
Nebenwirkungen: Die häufigsten Nebenwirkungen von Atezolizumab sind Erschöpfung (Fatigue), verminderter Appetit, Übelkeit, Atemnot, Durchfall, Hautausschlag und Entzündungen im Körper, die durch das stark aktivierte Immunsystem verursacht werden (Autoimmunreaktionen).
- Kombination Chemotherapie mit Antikörpern gegen PD-L1 (nur beim metastasierten Mammakarzinom)
- nabPac + Atezolizumab
- Pembrolizumab (Keytruda ®) Pembrolizumab ist ein sogenannter monoklonaler Antikörper gegen PD-1 (PD-1 Inhibitor). Er gehört zur Gruppe der Checkpoint Inhibitoren. Pembrolizumab blockiert den PD-1-Rezeptor von T-Zellen des Immunsystems. Dadurch kann der hemmende PD-L1 nicht mehr andocken und die Immunzellen behindern. Die Krebszelle bleibt für das Immunsystem sichtbar. So bewirkt Pembrolizumab eine Stimulation des Immunsystems. Pembrolizumab ist bei triple-negativen Brustkrebs (TNBC) in Kombination mit Chemotherapie zur neoadjuvanten und anschließend nach Operation als Monotherapie zur adjuvanten Behandlung bei hohem Rezidivrisiko (≥ T2, also Tumor grösser als 2 cm und positive Lymphknoten in der Achselhöhle) zugelassen (bei neoadjuvanter Situation keine PD-L1 Testung erforderlich). Außerdem kann es in Kombination mit Chemotherapie als erste Therapie beim lokal rezidivierenden nicht resezierbaren oder beim metastasierten triple-negativen Brustkrebs (TNBC) in Kombination mit Chemotherapie bei PD-L1-positiven Tumoren (Combined Positive Score [CPS] ≥ 10), wenn keine vorherige Chemotherapie zur Behandlung der metastasierenden Erkrankung stattgefunden hat.. Verabreichung: als Infusion (i.v.), also über einen Tropf in eine Vene Pembrolizumab wird alle drei Wochen (q21d) in einer Dosis von 200 mg als Infusion verabreicht – also über einen Tropf in eine Vene gegeben. Die Infusion dauert ungefähr 30 Minuten. Die Behandlung wird beendet, wenn die Erkrankung trotzdem weiter fortschreitet oder wenn die Nebenwirkungen zu stark sind. Dosierung: Der Wirkstoff wird mit einer Chemotherapie kombiniert. Die empfohlene Dosis von Pembrolizumab beträgt 200 mg alle 3 Wochen. Die Infusion dauert ungefähr 30 Minuten. Die Behandlung wird beendet, wenn die Erkrankung trotzdem weiter fortschreitet oder wenn die Nebenwirkungen zu stark sind. Nebenwirkungen: besonders immunvermittelte Nebenwirkungen durch eine Überreaktion des Immunsystems wie Pneumonitis, Kolitis, Hepatitis, Nephritis, Erkrankungen der hormonbildenden Organe (Endokrinopathien). Wechselwirkungen: keine bekannt oder zu erwarten.
- Kombination Chemotherapie mit Antikörpern gegen PD-1 (nur beim metastasierten Mammakarzinom)
- neoadjuvant Pac + Carboplatin -> Doxorubicin oder Epirubicin + Cyclophosphamid (AC/EC); metastasiert ebenfalls in Kombination mit einer Chemotherapie.
Bausteine der verschiedenen Therapie Schemata / Protokolle
- EC alle 2 Wochen (Epirubicin und Cyclophosphamid), (syn.: ECq2w, ECq14d)
- EC alle 3 Wochen (Epirubicin und Cyclophosphamid), (syn.: ECq3w, ECq21d)
- Pac 12 x wöchentlich (wöchentlich)
- Tz + Pz (Trastuzumab + Pertuzumab) (Antikörper gegen HER2)
- Carbo (Carboplatin)
- Bevacizumab (= Antikörper gegen VEGF)
- Atezolizumab (anti PD-L1 Antikörper)
- Pembrolizumab (anti PD-1 Antikörper)
Das Ansprechen eines Tumors auf eine Chemotherapie hängt von verschiedenen Faktoren ab:
- Empfindlichkeit der Tumorzellen gegenüber einer bestimmten Substanz (Chemo-Sensitivität oder aber auch Chemo-Resistenz): Durch eine Überprüfung des Tumors vor der Therapieentscheidung (invasiv duktal oder lobulär, welches Grading, welches Ki67, Hormonempfindlichkeit, HER2 Status), ist eine ungefähre Vorhersage der Wirksamkeit der Chemotherapie möglich.
- Größe und Durchblutung eines Tumors: die Chemotherapie kann die Krebszellen unterschiedlich gut erreichen.
Die immer weiter entwickelten Chemotherapie-Schemata haben beim Brustkrebs dazu beigetragen, die Überlebensraten deutlich zu verbessern!
CDK4/6 Inhibitoren (CDK4/6i): Palbociclib (Ibrance®), Ribociclib (Kisqali®), Abemaciclib (Verzenios®)
Die CDK4/6-Hemmer zählen zu den zielgerichteten Medikamenten, die bei Brustkrebs eingesetzt werden. Sie greifen im Zellzyklus der Krebszelle ein und blockieren die zyklinabhängigen Kinasen 4 und 6. Diese Enzyme regen im Zusammenspiel mit Cyclin D1 die Zellteilung an. Vor allem das Wachstum und die Teilung hormonempfindlicher (ER+, PR+) Brustkrebszellen hängen von diesen Enzymen ab. Die meisten gesunden Zellen bleiben verschont, weil dies für sie nicht gilt. Die CDK4/6 Inhibitoren werden in Kombination mit einer Antihormontherapie eingesetzt. Die Wirkung der Antihormontherapie wird dadurch deutlich verbessert, Resistenzen werden verhindert.
Zur Substanzklassen der CDK4/6 Inhibitoren zählen drei Medikamente:
- Palbociclib (Ibrance ®)
- Ribociclib (Kisqali ®)
- Abemaciclib (Verzenios ®)
Kombinationsmöglichkeiten mit Antihormontherapie in der Prämenopause:
- Fulvestrant + GnRHa + CDK4/6i (Palbociclib/Riboclib/Abemaciclib)
- AI + GnRHa + CDK4/6i (Palbociclib/Abemaciclib/Ribociclib)
Kombinationsmöglichkeiten mit Antihormontherapie in der Postmenopause:
- AI + CDK4/6i (Palbociclib/Riboclib/Abemaciclib)
- Fulvestrant + CDK4/6i (Palbociclib/Riboclib/Abemaciclib)
Bislang war eine Therapie mit CDK4/6-Inhibitoren nur in der metastasierten Situation und nur in Kombination mit einer Antihormontherapie möglich. Inzwischen ist auch die Zulassung von Abemaciclib (Verzenios®) in Kombination mit einer endokrinen Therapie in der adjuvanten Therapie bei hormonempfindlichem, HER2-negativen, nodal-positiven (also mit befallenen Lymphknoten) Brustkrebs und hohen Risiko erfolgt. Bei prä- oder perimenopausalen Frauen sollte die endokrine Aromatasehemmer-Therapie mit einem GnRHAgonisten kombiniert werden.
Anfang des Jahres 2025 wird auch Ribociclib in der adjuvanten Situation bei Frauen nach adjuvanter oder neoadjuvanter Chemotherapie und hohem Rückfallrisiko eingesetzt.
Die CDK4/6-Inhibitoren haben ein insgesamt sehr günstiges Nebenwirkungsprofil. Die Lebensqualität der Patientinnen ist oft genauso gut oder sogar besser als unter alleiniger antihormoneller Therapie.
Dennoch gibt es spezielle zusätzliche Nebenwirkungen dieser Substanzen:
- Palbociclib (Ibrance®): Abfall der weißen Blutkörperchen (Neutropenie)
- Ribociclib (Kisqali®): Abfall der weißen Blutkörperchen (Neutropenie); Herzrhythmus-Veränderung im EKG (QT-Zeit Verlängerung)
- Abemaciclib (Verzenios®): Abfall der weißen Blutkörperchen (weniger häufig als bei Palbociclib und Ribociclib); Durchfall
mTOR Inhibitoren Everolimus (Afinitor®)
mTOR Inhibitoren zählen auch zu den zielgerichteten Medikamenten, die bei Brustkrebs eingesetzt werden. Sie wirken, wie der Name schon sagt, durch eine Hemmung von mTOR. Dadurch werden z.B. Wachstum, Ernährung und Blutgefäßbildung und -versorgung von hormonempfindlichen Brustkrebszellen verringert. Das Medikament Everolimus (Afinitor) wird in Kombination mit einer Antihormontherapie beim metastasierten Brustkrebs eingesetzt. Die Wirkung der Antihormontherapie wird dadurch deutlich verbessert, Resistenzen werden verhindert.
Die mTOR Inhibitoren werden oral (als Tabletten) eingenommen und haben ein insgesamt relativ günstiges Nebenwirkungsprofil. Mögliche Nebenwirkungen sind z.B. eine Entzündung der Mundschleimhaut (Stomatitis), eine Art der Lungenentzündung (Pneumonitis), Nasenbluten, Müdigkeit / Fatigue, Husten, Durchfall, Hautreaktionen (Ausschlag, Juckreiz) und ein erhöhter Blutzuckerspiegel.
Folgende Kombinationsmöglichkeiten mit Antihormontherapie sind möglich:
- AI* (Exemestan) + mTORi (Everolimus)
- Tamoxifen + mTORi (Everolimus)
- Fulvestrant* + mTORi (Everolimus)
*Bei Patientinnen vor den Wechseljahren müssten GnRHa hinzugenommen werden.
PIK3CA Hemmer: Alpelisib (Piqray®), Inavolisib (Aleclibran®)
Beim metastasierten hormonempfindlichen (HR+) Brustkrebs gibt es eine weitere zielgerichtete Substanz, die mit einer Antihormontherapie kombiniert werden kann: einen sogenannten PIK3CA-Hemmer (Alpelisib, Piqray®). Diese Kombination verbessert das Überleben deutlich. Dieser kann nur bei Nachweis einer PIK3CA-Mutation wirken, welche bei etwa 40% der hormonempfindlichen metastasierten Mammakarzinome vorliegt. Eine PIK3CA-Mutation bewirkt ein schnelleres Wachstum von Krebszellen und einen schlechteren Krankheitsverlauf. Ob bei Ihrem Tumor eine PIK3CA-Mutation vorliegt, kann an Gewebeproben untersucht werden. Wenn bei Ihnen eine PIK3CA-Mutation nachgewiesen wird, kann eine Kombinationstherapie aus Fulvestrant + Alpelisib durchgeführt werden. Bei jungen (prämenopausalen) Frauen muss die Eierstocksfunktion mittels GnRHa-Gabe ausgeschaltet werden, um Fulvestrant wirksam einsetzen zu können.
Alpelisib wird oral (als Tablette) eingenommen. Mögliche Nebenwirkungen von Alpelisib sind: Hyperglykämie, Durchfall, Übelkeit, verminderter Appetit, Hautausschlag.
Zum 1.05.2001 erfolgte trotz weiter bestehender Zulassung eine Marktrücknahme vom deutschen Markt. Es ist jedoch ein Bezug über die internationale Apotheke und die Beantragung der Kostenübernahme bei der Krankenkasse notwendig.
In Kürze wird die Zulassung eines weiteren PIK3CA- Hemmer erwartet: Inavolisib (Aleclibran®).
Inavolisib ist zugelassen für die Behandlung von postmenopausalen Frauen mit HR+/HER2– metastasiertem Brustkrebs mit nachgewiesener PIK3CA-Mutation, wenn Metastasen während einer antihormonellen Therapie oder innerhalb von 12 Monaten nach deren Ende auftreten.
Wird eine PIK3CA-Mutation nachgewiesen, kann Inavolisib zusammen mit Fulvestrant (Antihormontherapie) und Palbociclib (CDK4/6-Hemmer) eingesetzt werden. Bei jungen (prämenopausalen) Frauen muss zusätzlich die Eierstockfunktion medikamentös unterdrückt werden, damit Fulvestrant wirken kann.
Inavolisib wird als Tablette eingenommen. Mögliche Nebenwirkungen sind U. a. erhöhter Blutzucker, Hautausschlag, Übelkeit, Müdigkeit, Entzündung der Mundschleimhaut, Infektionen (COVID 19, Harnwegsinfektionen, Lungenentzündungen).

PARP Inhibitoren Olaparib (Lynparza®), Talazoparib (Talzenna®)
Die PARP-Inhibitoren Olaparib (Lypnarza®) und Talazoparib (Talzenna®) zählen zu der Gruppe der zielgerichteten Medikamente. Sie blockieren die Enzyme PARP = Poly-[ADP-Ribose-]Polymerase, die eine wichtige Rolle bei der Reparatur der Erbinformation (DNA) von Zellen spielen. Wenn diese Enzyme gehemmt werden, kann die Zelle Schäden nicht mehr reparieren und es kommt zum Zelltod. Die PARP-Inhibitoren sind aus der Behandlung des Eierstockskrebs schon einige Jahre bekannt.
Seit 2019 darf Olaparib (Lynparza®) auch zur Therapie von Brustkrebs verwendet werden. Behandelt werden dürfen:
1. Frauen mit einer BRCA-Mutation mit lokal fortgeschrittenem oder metastasiertem, HER2-negativem Mammakarzinom, das bereits vor therapiert wurde (Monotherapie) und
2. Frauen mit einer BRCA-Mutation mit einem HER2-negativen Brustkrebs im Frühstadium mit hohem Rezidivrisiko nach vorheriger Behandlung mit einer (neo)adjuvanten Chemotherapie (Monotherapie oder in Kombination mit einer endokrinen Therapie, adjuvant).
Olaparib wird bei Brustkrebs als Monotherapie in Tablettenform angewendet.
Olaparib verursacht eher milde Nebenwirkungen: Blutbildveränderungen wie Blutarmut (Anämie) und eine reduzierte Anzahl der weißen Blutkörperchen (Neutropenie), Übelkeit und Erbrechen.
Talazoparib (Talzenna®): Ein weiterer in Europa nun zugelassener PARP-Inhibitor ist Talazoparib. Auch dieser PARP-Inhibitor wird als Monotherapie für die Behandlung von Patientinnen mit BRCA1/2-Mutationen in der Keimbahn angewendet, die ein HER2-negatives, lokal fortgeschrittenes oder metastasiertes Mammakarzinom haben. Die Nebenwirkungen von Talazoparib sind wie bei Olaparib Blutbildveränderungen, Übelkeit und Erbrechen.

Newsletter abonnieren und nichts mehr verpassen
Erhalten Sie regelmäßig Infos rund um Ihre Erkrankung sowie Neuigkeiten zu den Angeboten von PINK! – jetzt anmelden!